항균시험법 설명자료
페이지 정보

본문
항균 시험법의 결정에 도움을 드리기 위한 자료입니다.
Ⅰ. 항균 시험 소개
1. 항균 시험 개요
[시험 구분 및 원리] | |
구분 | 수행 내용 |
1. 항균활성 평가 (paper disc법) | Kirby Bauer의 디스크 확산법의 원리는 디스크에 함유된 항생제가 한천으로 확산하며 균 생장을 저해하는 정도를 확인하는 것임 6mm 여과지 디스크에 알려진 농도의 항생물질을 함침시킨 후 Mueller-Hinton(MH) 한천에 놓으면, 플레이트에서 즉시 물이 한천에서 디스크로 흡수되어 그만큼 항생물질이 주변 한천으로 확산되기 시작함. 한천을 통한 물질의 확산 속도는 디스크에서 물질이 추출되는 속도만큼 빠르지 않으므로 디스크에 가장 가까운 영역이 항생물질 농도가 가장 높고 디스크에서 멀어질수록 물질의 농도는 대수적으로 감소함. 한천을 통한 항생물질의 확산 속도는 MH 한천에서의 약물의 용해도 특성 및 항균 화합물의 분자량에 영향을 받음. 분자량이 더 큰 분자는 저분자량 화합물보다 느린 속도로 확산됨. 이로 인해 각 항균제는 해당 항균 화합물에 대한 민감성을 나타내는 고유한 저해환의 크기를 갖게 되며, 저해환의 존재는 해당 농도에서 항균 활성이 있는 것으로 평가함 |
2. 항균활성 평가 (최소저해농도시험법) | 정성시험인 디스크확산법을 통해 항균 효능이 확인된 시료는 유효농도 (사용농도) 결정을 위한 최소저해농도를 수행할 수 있음 최소저해농도는 제품에 항균 성분의 함유량( 또는 제품 반응시 사용량)을 결정할 때 참고할 수 있음 (항균 성분의 최소저해농도가 5%인 경우, 제품에 해당 성분을 5%가 되도록 첨가함) 최소저해농도 시험은 시료 및 양성대조군 용액을 준비하고 농도를 점차 올려가며, 용액을 배양된 세균 무리와 함께 배양시키는 액체배지 미량희석법 (broth microdilution)을 통해 결과를 측정함. 최소저해농도는 물질이 균 성장을 막는 최저 농도를 의미함. |
3. 항균활성 평가 (살균/소독 시험법) | 특정 농도의 시료와 균액을 일정 시간 동안 접촉한 후, 중화, 회수하여 균 감소율을 평가하는 시험 시료의 특성에 따라 중화제의 종류가 결정될 수 있으며, 시료의 사용 환경에 따라 시험조건 (청정 조건, 오염 조건, 현탁액 시험, 모의표면 시험 등) 별로 평가할 수 있음 시험 결과는 대조군 대비 시험군(시료 반응군)의 일정 시간 반응 후의 균감소를 log reduction 및 백분율로 산출함 |
2. 항균활성 평가 (paper disc법)
(1) 시료의 적용농도 결정 및 stock solution 제조
분양 정보에 따라 제공된 시료는 용매를 사용하여 최고 용해도로 stock solution을 제조함
Kirby Bauer의 디스크 확산법(Kirby Bauer Disk Diffusion Method)에 따라 시험을 실시함
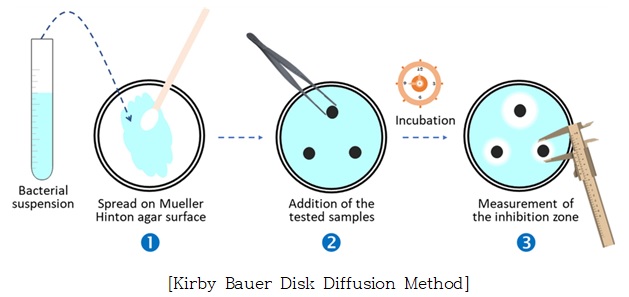
❍ 세부 시험방법
① 균액의 조제 및 도말
- 시험대상 균주는 권장 배지인 Mueller Hinton broth 및 Potato dextrose broth에 접종하여 각 배양 온도에서 전배양 함
- 박테리아 및 칸디다균은 2회 계대 배양을 거친 후 0.5 McFarland standard 용액과 유사한 수준의 탁도로 균액을 희석하여 실험용으로 준비함 (McFarland 표준은 박테리아 밀도를 시각적으로 비교할 수 있는 황산바륨 또는 라텍스 입자의 현탁액으로 0.5 McFarland standard 용액의 625nm에서 흡광값 0.08~0.13의 수치는 E.coli 기준 1x108 ~ 2x108 CFU/㎖ 수준의 균 생장 정도와 일치함)
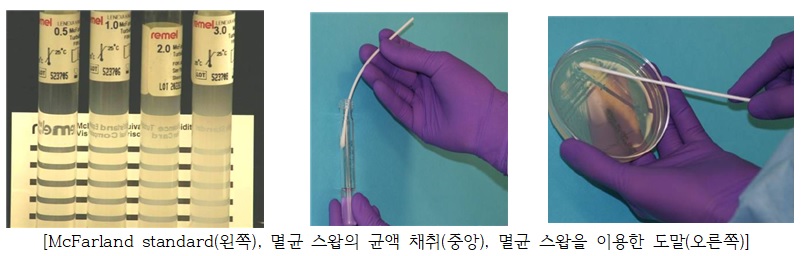
- 항균 시험 시점에서 미생물의 생장 단계는 대수증식기 (log phase)에 있어야 하므로, 전날 계대 배양 뿐만 아니라, 당일 탁도 조정 후에도 15분 이내로 균액을 사용하여야 함
- 0.5M McFarland standard 용액과 유사한 수준의 탁도로 준비된 균액은 멸균 스왑을 담그어 균액을 취한 다음, 스왑을 벽면에 닿게 하여 과량의 균액을 제거함
- 균액을 취한 스왑은 준비된 Mueller Hinton agar 배지 위에서 지그재그로 전후 방향으로 획선 도말함
② paper disc에 시료 물질 로딩(loading)
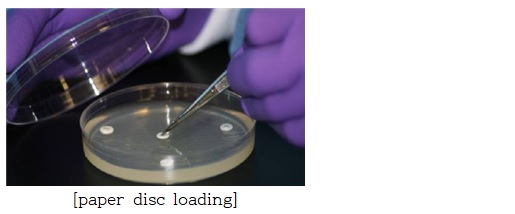
[paper disc loading]
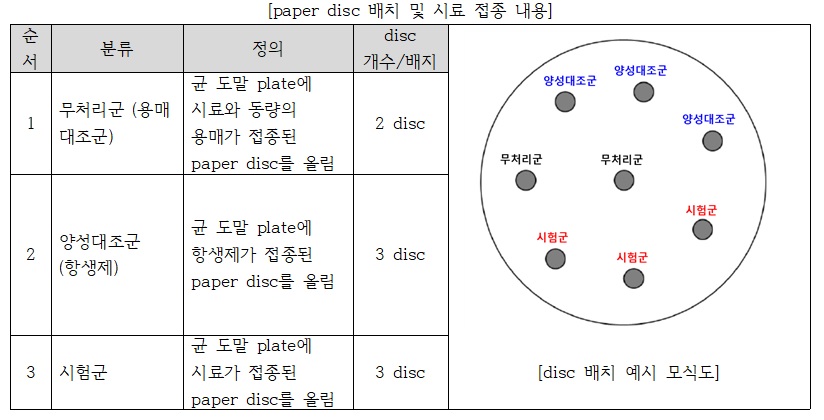
멸균된 6mm paper disc를 준비하여 균액이 도말된 Mueller Hinton agar 배지 중앙과 가장자리 부위에 disc를 올림. 이때, disc 간 간격은 24mm를 넘지 않도록 하며 한 배지당 8개의 disc를 올림
- 각 disc에 시료 또는 양성대조군 항생제를 20㎕씩 동일 부피를 로딩함. 배지 1개당 총 8개의 disc에 하기의 군으로 나누어 로딩함.
- 균 도말이 균일한 조건에서 진행되고, 재현성 확인을 위하여 해당 시험은 3회 반복 수행함
③ 배양 및 저해환 지름 측정
- 시료 로딩 후 배지는 균주별 배양 온도에서 18시간 이상 배양함
- 미생물 생육 저해환 (inhibition zone 또는 clear zone)의 지름을 측정함
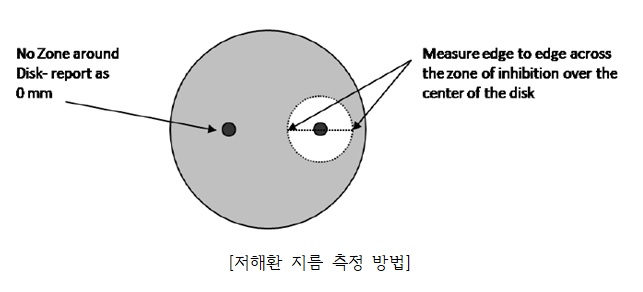
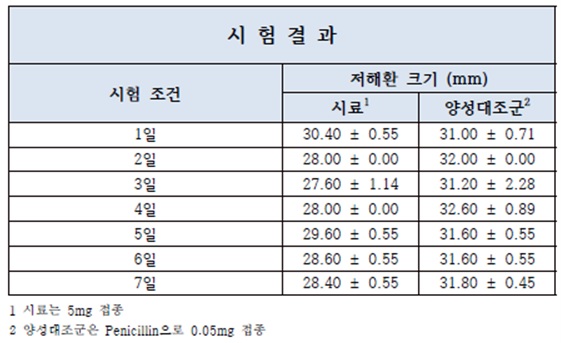
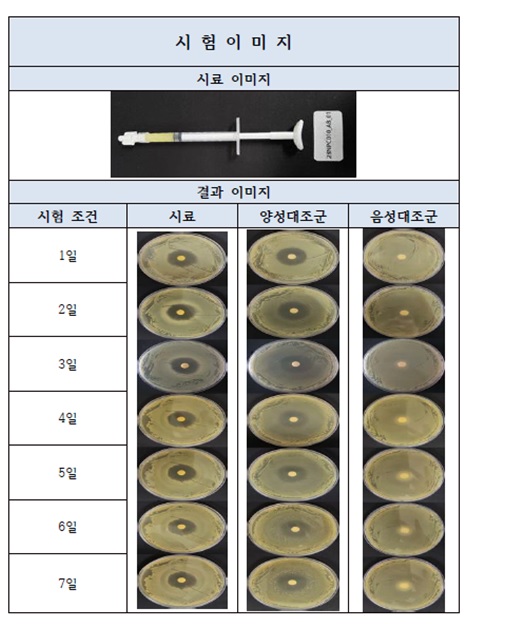
❍ 시험 결과의 예시
3. 항균활성 평가 (최소저해농도시험법)
① 미세 희석 플레이트 (96well plate)에서 시험물질과 양성대조군 항생제를 2배 연속희석물을 준비함
② 멸균 스왑으로 한천 플레이트에서 몇 군집을 취하여 MCFarland 표준을 준비하고 탁도를 맞추어 균액을 준비함
③ 균액을 연속 희석된 시험물질이 담긴 96well plate에 분배한 다음 권장 온도에서 배양함
④ 96well plate를 플레이트 분광광도계 (microplate reader)를 사용하여 625nm에서 탁도를 측정함
⑤ 균 성장이 완전히 저해되는 가장 낮은 농도를 최소저해농도(MIC)로 결정함
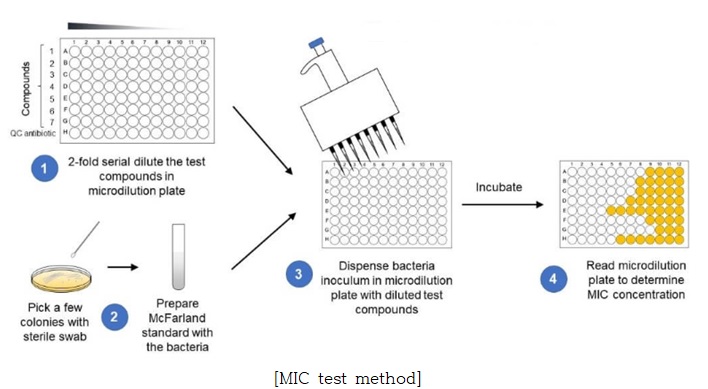
❍ 시험 결과의 예시

4. 항균활성 평가 (살균/소독 시험법)
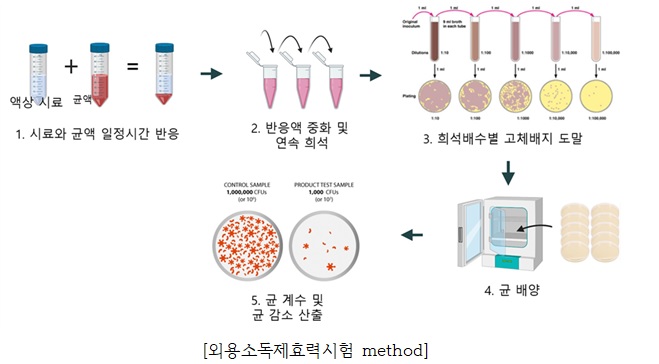
(1) 시험대상 균주
대한민국약전 일반시험법 중 미생물 한도시험법에 제시된 균주를 참고
(ex) 포도상구균(Staphylococcus aureus) ․ 대장균(Escherichia coli) ․ 녹농균(Pseudomonas aeruginosa) ․ 바실러스(Bacillus cereus) ․ 살모넬라(Salmonella typhimurium)
(2) 평가
① 시험장소 분리된 공간의 무균시험에 적합한 클린벤치에서 행해져야 하며, 시험에 사용하는 기구들은 멸균상태이어야 한다.
② 시험법
가. 균액의 조제
가) 시험대상 균주 5종을 각각 멸균된 NB(Nutrient Broth) 5mL가 담긴 round bottom tube에 접종하여 37℃에서 18~22시간 동안 배양한 후, 600 nm에서 흡광도를 측정 하여 균의 배양정도를 확인.
나) 시험대상 균주 5종의 초기 배양액을 NB 배지(4℃ 냉장보관)로 10배씩 계열 희석하여 균액 mL당 1x105 CFU가 되도록 준비한다.
다) 균액(1x105 CFU/mL) 0.1 mL를 새로운 eppendorf tube에 넣고 원심 분리(9,300 RCF, 1분)한 후, 상등액을 제거한다.
나. 시험군 및 대조군의 조제
가) 시험군은 균액에 외용소독제 1 mL를 넣고 잘 현탁한 후 실온에서 1~5분간 방치.
나) 대조군은 균액에 PBS(Phosphate Buffer Saline) 완충액 1 mL를 넣고 잘 현탁한 후 실온에서 1~5분간 방치한다.
다. 시험군 및 대조군의 배지 도말
가) 1~5분간 방치된 시험군(균액/외용소독제) 및 대조군(균액) 각각을 원심분리(9,300 RCF, 1분)한 후, 상등액을 제거하고 다시 TSB 배지 또는 PBS 완충액 1 mL를 넣어 침전물을 잘 현탁한다.
나) 가)에서와 같은 조건으로 다시 원심분리를 한 후 상등액을 제거하는 세척 과정을 2회 반복한 다음 최종으로 침전물에 TSB 배지 또는 PBS 완충액 1 mL를 넣어 잘 현탁한다.
다) 나)에서 마련된 균액 0.1 mL씩을 각각 3개 이상의 TSA(Tryptoic Soy Agar, 대두카제인소화한천) 배지에 도말한 후, 37℃에서 20~24 시간 배양한다.
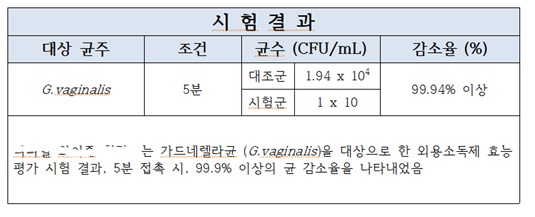
라. 저해율(%) 계산 및 평가
저해율(%)=[대조군 균수(CFU)-시험군 균수(CFU)]/대조군 균수(CFU) X 100
가) 각 군에서 형성된 집락(colony)수를 계수하고, 외용소독제를 처리 하지 않은 대조군과 비교하여 외용소독제 처리군의 저해율(%)을 계산한다.
나) 각각의 균에 대한 저해율이 99.9% 이상이어야 한다.

- 이전글2024년 중소기업 혁신바우처사업 수행기관 24.07.31
- 다음글[브로슈어] 바이오시험분석 서비스 24.02.27
댓글목록
등록된 댓글이 없습니다.


